Рак мочевого пузыря
Рак мочевого пузыря - симптомы и лечение
Рак мочевого пузыря — заболевание, при котором в слизистой оболочке мочевого пузыря образуются злокачественные клетки. Мочевой пузырь расположен в малом тазу и выполняет резервуарную и выделительную функции. В него по мочеточникам из почек поступает моча. Изнутри полость этого органа выстилает особый тип эпителия — уротелий.
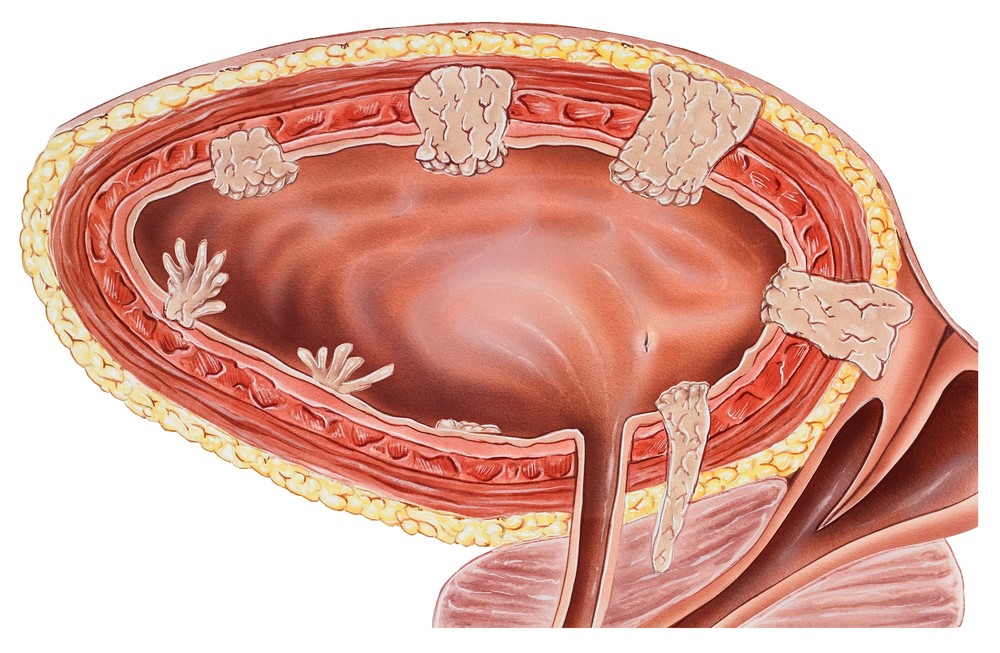
Ежегодная мировая статистика свидетельствует о более чем 430 000 новых случаев заболевания (330 380 мужчин и 99 413 женщин), и эта цифра продолжает возрастать. В России рак мочевого пузыря занимает третье место среди онкоурологических заболеваний, после рака предстательной железы у мужчин и рака почки у женщин (26,2% от всех злокачественных новообразований мочеполовой системы). В 2017 г. в нашей стране было впервые зарегистрировано 17277 случаев заболевания: 13635 у мужчин и 3530 у женщин. В структуре онкологической заболеваемости на долю рака мочевого пузыря в 2016 г. приходилось 4,6%.
Факторы риска:
- Курение. У курильщиков злокачественные опухоли мочевого пузыря развиваются в 4-7 раз чаще, в отличие от некурящих;
- Возраст. Шансы диагностировать рак мочевого пузыря увеличиваются с возрастом. 90% людей с этим заболеванием старше 55 лет, а средний возраст людей с этим диагнозом — 73 года.
- Пол. У мужчин в 3-4 раза чаще развивается РМП, чем у женщин, но для последних заболевание чаще становится смертельным;
- Раса. Показатели заболеваемости у белых мужчин в два раза выше, чем у чернокожих, и в восемь раз, чем у индейцев. Чернокожие вдвое чаще погибают от этого заболевания;
- Химические вещества. Некоторые промышленные и природные химические вещества, а также употребление хлорированной воды и содержащегося в воде мышьяка могут увеличить риск развития рака мочевого пузыря;
- Лекарственные препараты. Фенацетинсодержащие анальгетики повышают риск заболевания РМП в 2,0–6,5 раза при их постоянном применении;
- Хронические заболевания мочевого пузыря. Камни, инфекции мочевого пузыря, а также использование катетеров у парализованных людей могут увеличить риск развития рака мочевого пузыря;
- Водный режим. Доказана обратная связь между объемом потребляемой жидкости и риском РМП. У мужчин с наибольшим потреблением жидкости (более 2531 мл/день) риск РМП был приблизительно вдвое ниже, чем в группе с наименьшим потреблением (1290 мл/день). Установлена статистически значимая зависимость между потреблением жидкости <3000 мл в день для людей, живущих в Америке, и <2000 мл в день для европейских мужчин и риском возникновения РМП;
- Циклофосфамид (Cytoxan, Clafen, Neosar). Люди, перенесшие химиотерапию циклофосфамидом, имеют более высокий риск развития рака мочевого пузыря;
- Шистосомоз. Люди с некоторыми формами этой паразитарной болезни, которая встречается в некоторых частях Африки, Южной Америки, Юго-Восточной Азии и на Ближнем Востоке, с большей вероятностью имеют риск развития плоскоклеточного рака мочевого пузыря:
- Синдром Линча. Люди с синдромом Линча (ранее называемым наследственным неполипозным колоректальным раком, или HNPCC), могут иметь повышенный риск развития рака мочевого пузыря;
- Высококалорийное питание.
Злокачественные опухоли мочевого пузыря сопровождаются отчетливой клинической симптоматикой. Иногда у людей с раком мочевого пузыря нет каких-либо изменений (бессимптомное течение) или причиной симптома может быть другое заболевание, которое не является раком.
Cимптомы рака мочевого пузыря:
- кровь в моче;
- частое и болезненное мочеиспускание;
- никтурия (частые ночные мочеиспускания);
- односторонние боли в пояснице;
- необъяснимая потеря аппетита и веса.
Как правило, первым признаком, позволяющим заподозрить заболевание, становится кровь в моче (встречается у 92% больных с опухолями мочевого пузыря). Иногда в моче содержится небольшое незаметное количество крови (микроскопическая гематурия), которое можно определить только с помощью анализа мочи. Со временем уменьшается емкость мочевого пузыря, а мочеиспускание становится более частым и болезненным, а гематурия — интенсивнее и продолжительнее. Появляется анемия.[6]
Общий анализ мочи не используют для специфического диагноза рака мочевого пузыря, поскольку содержание крови в моче может быть признаком других, нераковых заболеваний, например, инфекции или мочекаменной болезни.
В некоторых случаях появление первых симптомов рака мочевого пузыря становится признаком того, что раковые клетки уже распространились на другой орган. Тогда по симптоматике можно определить, куда именно распространилась опухоль: если на легкие, признаком может быть кашель или одышка, если в печень — боли в животе или желтуха, в кости — боли в костях или переломы.
Ведущими симптомами рака мочевого пузыря являются макрогематурия и дизурические расстройства. Выраженность клинических проявлений определяется стадией заболевания.
Классификация и стадии развития рака мочевого пузыря
Тип рака мочевого пузыря зависит от того, какое он имеет клеточное строение и как выглядит под микроскопом. Различают 3 типа рака мочевого пузыря:[6]
- Уротелиальная карцинома. Уротелиальная карцинома составляет около 90% всех случаев РМП. Она возникает в уротелиальных клетках слизистой оболочки МП. Уротелиальная карцинома — это обобщающий термин, ранее использовалось другое название — переходно-клеточный рак.
- Плоскоклеточная карцинома. Развиваются в плоскоклеточном эпителии мочевого пузыря. Плоскоклеточная карцинома составляет около 4% от всех случаев рака мочевого пузыря.
- Аденокарцинома. Этот тип составляет около 2% всех случаев рака мочевого пузыря и возникает из железистых клеток.
Существуют и другие менее распространенные типы рака мочевого пузыря, в такие, как саркома, мелкоклеточная карцинома и др. Саркома начинается в жировых или мышечных слоях мочевого пузыря. Мелкоклеточная карцинома возникает из нейроэндокринных клеток.
В дополнение к типу клеток, РМП можно охарактеризовать как неинвазивный, мышечно-неинвазивный или мышечно-инвазивный.
- Немышечно-инвазивный. Неинвазивный рак мочевого пузыря прорастает в собственную пластинку слизистой оболочки. Немышечно-инвазивный рак также можно назвать поверхностным раком.
- Мышечно-инвазивный. Мышечно-инвазивный рак мочевого пузыря проникает в мышечный слой стенки мочевого пузыря, а иногда и в жировые слои или окружающие ткани за пределами мочевого пузыря.
Выделяют неинвазивные папиллярные опухоли (папиллярная уротелиальная опухоль с низким злокачественным потенциалом, low-grade — папиллярный уротелиальный рак, high grade — папиллярный уротелиальный рак), плоские поражения (carcinoma in situ или CIS) и инвазивный рак (инвазия в мышечный слой, жировую клетчатку). Все варианты уротелиальных опухолей, описанных для мочевого пузыря, также могут встречаться в верхних мочевыводящих путях.[6]
Одним из инструментов, которые используют врачи для описания рака, является система TNM. Используя различные диагностические тесты, врачи отвечают на ряд вопросов:
- Опухоль (T) Тumor: Насколько велика первичная опухоль? Где она находится?
- Узел (N) Nodulus: опухоль распространяется на лимфатические узлы? Если да, то где и сколько?
- Метастазы (М) Metastasis: рак метастазирует в другие части тела? Если да, то где и сколько?
Стадирование рака мочевого пузыря
Полученные результаты объединяются для того, чтобы определить стадию рака индивидуально для каждого человека. В таблице представлена TNM классификация (Union Internationale Contre le Cancer 2009), широко используемая врачами-урологами.

Согласно TNM классификации, в качестве регионарных лимфоузлов рассматриваются лимфоузлы ворот почки, парааортальные, паракавальные и, для мочеточника, внутритазовые лимфоузлы. Сторона поражения не влияет на N классификацию.
Для уротелиального рака согласно действующей системе ВОЗ/Международного общества уропатоморфологов (WHO/ISUP) рекомендуется следующее разделение по степеням дифференцировки:[6]
- LG— low-grade (высокая степень дифференцировки);
- HG— high-grade (низкая степень дифференцировки).
Стадирование и степень дифференцировки РМП
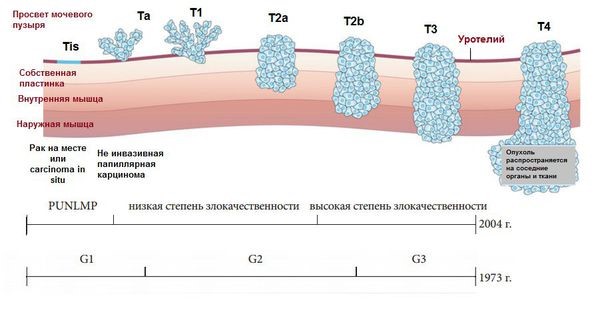
Согласно классификации ВОЗ/ISUP 2004 года, среди уротелиальных опухолей выделяют:
- папиллярную опухоль уротелия с низким злокачественным потенциалом;
- папиллярный уротелиальный рак низкой степени злокачественности;
- папиллярный уротелиальный рак высокой степени злокачественности.
PUNLMP определяется как образование, которое не имеет цитологических признаков злокачественности, но нормальные клетки уротелия объединяются в папиллярные структуры.
Если опухоль мочевого пузыря распространилась на окружающие органы, такие как матка и влагалище у женщин, простата у мужчин и/или близлежащие мышцы, это называется местно-распространенным заболеванием. Рак мочевого пузыря также часто распространяется на лимфатические узлы в области таза. Если он распространился в печень, кости, легкие, лимфатические узлы вне таза или другие части тела, рак называется метастатическим заболеванием.
Европейская организация по исследованию и лечению рака (EORTC) предложила систему распределения больных раком мочевого пузыря на 3 группы риска и прогрессии: низкого, высокого и промежуточного.
При первичном обращении у 74,2% больных выявляются опухоли в I-II стадии, и только у 25,8% больных диагностируется инвазивный рак, в III-IV стадии опухолевого процесса.
Осложнения рака мочевого пузыря
Локализация опухоли мочевого пузыря в области устья мочеточника может вызвать нарушение оттока мочи, что может сопровождаться приступами почечной колики либо тупой постоянной болью в области поясницы. Сдавление устья мочеточника — наиболее трагический признак заболевания, сопровождающийся функциональными изменениями почек. Инвазивный рак мочевого пузыря в большинстве случаев осложняется пиелонефритом и почечной недостаточностью. Инфицирование мочи проявляется клиникой вторичного цистита (в 51% случаев). По мере нарастания стадии процесса частота цистита увеличивается. Метастазы рака мочевого пузыря обнаруживаются в головном мозге, костной системе и легких. Гематурия может быть терминальной.
Наиболее часто встречающиеся осложнения рака мочевого пузыря:
- анемия;
- уретерогидронефроз;
- почечная недостаточность;
- инфекции;
- хроническая задержка мочеиспускания.
Диагностика рака мочевого пузыря
Предварительная клиническая стадия устанавливается по данным уретроцистокопии/трансуретральной резекции с последующим гистопатологическм исследованием биопсийного материала. Карциному in situ диагностируют по сочетанию цистоскопии, цитологического анализа мочи и гистологического исследования материала нескольких биопсий слизистой оболочки мочевого пузыря.
Компьютерная томография с урографией на сегодняшний день является методом выбора при обследовании пациентов с подозрением на РМП, заменившим ультразвуковое исследование.[4] Установлено, что чувствительность этого метода в отношении мышечно-неинвазивного РМП находится в пределах от 67 до 100%, а специфичность — в пределах от 93 до 99% в зависимости от используемой методики и оборудования.[4] МСКТ-урография может выявить утолщение стенки почечной лоханки или мочеточников, являющееся признаком уротелиального рака верхних мочевыводящих путей, даже при отсутствии роста в просвет органа, к сожалению, плоские опухоли выявить невозможно.[2][7]
Цитологическое исследование осадка мочи является «золотым» стандартом неинвазивной диагностики РМП, которое является дополнением к цистоскопии при выявлении злокачественных опухолей МП высокого риска (High grade) рецидивирования и прогрессирования с чувствительностью 80-90% и специфичностью 98-100%.[4]
В последнее время предложены и применяются различные методы лабораторной диагностики РМП: UroVysion, анализ на микросателлиты, иммуноциты/uCyt+, цитокератины, определение ВТА (bladder tumor antigen), NMP 22 (nuclear matrix protein), антигена UBC (urinary bladder cancer), теломеразы мочи и др.[4] При специфичности 55-98%, чувствительность NMP 22 составила 47-100%, BTA stat — 29-83%, UBC — 64%, проточной цитометрии — 61%, UroVysion — 30-86%, анализа на микросателлиты — 58-92%, иммуноциты/uCyt+ — 50-100%, цитокератинов — 12-88%.
Трансабдоминальное УЗИ почек и мочевого пузыря может использоваться в ходе первичного обследования пациентов с гематурией, согласно рекомендациям EAU 2013 г. и 2016 г.[2][4] Однако следует помнить, что оно не может заменить компьютерную томографию с урографией для диагностики уротелиальной карциномы верхних отделов мочевых путей из-за низкой чувствительности метода.[4] Чувствительность ультразвукового исследования при определении стадии опухолевого процесса составляет 80,6% при Т1 стадии, 91,2% при Т2 стадии и 93,3% при Т3-4. Цветное допплеровское ультразвуковое исследование обладает хорошей чувствительностью, но плохой специфичностью для диагностики низкодифференцированных опухолей мочевого пузыря.[2][7]
Уретероцистоскопия/трансуретральная резекция опухолей мочевого пузыря в «белом свете» в настоящее время по-прежнему являются наиболее широко используемыми и доминирующими инвазивными методами обнаружения опухолей мочевого пузыря и остаются достаточно надежными для определения стадии и степени дифференцировки опухоли, позволяют установить размеры, количество, локализацию опухоли (ей) МП.[4]
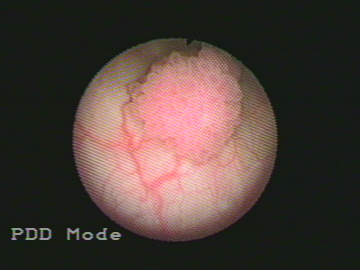
Наиболее ценным методом в отношении диагностики РМП в рутинной клинической практике, чем традиционная уретероцистоскопия в «белом свете» является узкоспектровая (узкополостная) цистоскопия, её специфичность составляет 67,4%, а чувствительность приближается к 93,3%.[3] Узкоспектровое (NBI — narrow band imaging) изображение является новой медицинской технологией.
Современные технологии визуализации РМП классифицируются на основе макроскопического, микроскопического и молекулярного поля зрения.[2][7]Макроскопические техники, такие как фотодинамическая цистоскопия и узкополосная визуализация, схожи с цистоскопией в «белом свете», однако способны визуализировать даже самые незначительные поражения слизистой оболочки мочевого пузыря благодаря использованию повышенной контрастности. Микроскопические техники, такие как оптическая когерентная томография и конфокальная лазерная эндомикроскопия, позволяют получать в высоком разрешении изображения везикулярных тканей в разрезе, которые очень схожи с изображениями, получаемыми при гистопатологических исследованиях.[7] Поэтому подобные исследования часто называют «оптической биопсией». Совмещая все эти методы, урологи могут получать в реальном времени высокоспецифичные изображения раковых клеток и дифференцировать их от здоровых.
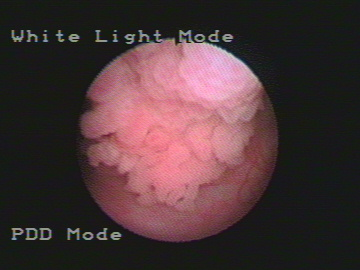
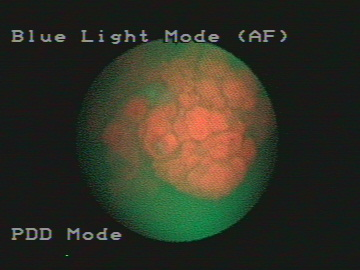
Из 4 технологий цистоскопии в «белом свете», флуоресцентной цистоскопии, фотодинамической диагностики и конфокальной лазерной эндомикроскопии, последняя имеет наивысшее разрешение (от 2 до 5 мкм) и может обеспечить оптическую биопсию, выявив микроархитектуру и клеточную морфологию предполагаемых поражений in vivo.
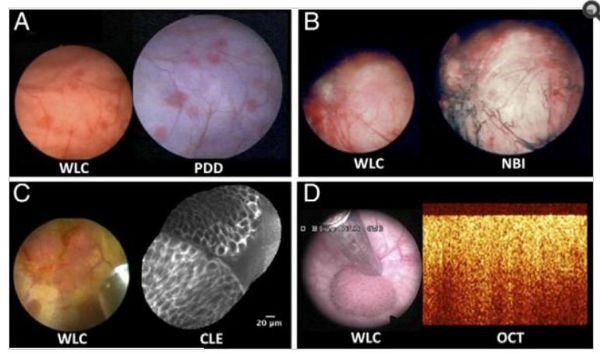
Современные технологии оптической визуализации РМП.[3][8] А — WLC-цистоскопия в «белом свете» и PDD — фотодинамическая диагностика; B – WLC-цистоскопия в «белом свете» и NBI —флуоресцентная цистоскопия; C — WLC-цистоскопия в «белом свете» и CLE — конфокальная лазерная эндомикроскопия; D-WLC-цистоскопия в «белом свете» и OCT — оптическая когерентная томография.
Лечение рака мочевого пузыря
Главным методом лечения большинства больных злокачественными новообразованиями МП остаётся оперативное вмешательство. Хирургический метод признан основным в лечении больных РМП во всем мире.
С клинической точки зрения в выборе лечения играет значимую роль подразделение рака мочевого пузыря на неинвазивный или мышечно-неинвазивный и мышечно-инвазивный. Развитие мышечно-неинвазивного РМП (Tis, Ta, T1) трудно предугадать. Два основных фактора определяют судьбу пациента с мышечно-неинвазивным РМП: рецидивирование и прогрессирование заболевания. Мышечно-неинвазивный (Tis, Ta, T1) рак МП имеет непредсказуемое течение и обладает опасностью быстрого рецидивирования. В 40–80% случаев после трансуретральной резекции (ТУР) в течение 6–12 мес. развивается рецидив, а у 10–25% больных — инвазивный рак. С каждым новым рецидивом улетучиваются надежды на сохранение мочевого пузыря.
Лечение мышечно-неинвазивного рака мочевого пузыря
Принципиальная стратегия лечения мышечно-неинвазивного РМП основывается на радикальном удалении опухоли, предотвращении рецидивирования, метастазирования и перерождения в инвазивные формы рака.
Существуют различные виды органосохраняющего хирургического лечения РМП:
- трансвезикальная резекция МП;
- ТУР — трансуретральная резекция;
- ТУР-вапоризация — разновидность электрохирургического лечения, объединяющая в себе преимущества резекции и «выпаривания» ткани.
С появлением современных эндоскопических методик для хирургического лечения мышечно-неинвазивных опухолей МП метод трансвезикальной резекции стал редким вмешательством.
Согласно современным рекомендациям Европейской ассоциации урологов (2017), признанным стандартом хирургического органосохранного лечения пациентов с мышечно-неинвазивным РМП считается проведение первичной лечебно-диагностической ТУР МП.[4]Целями вмешательства являются: верификация диагноза и стадирование опухоли (определение категории Т, степени дифференцировки опухоли), определение возможных рисков рецидивирования и прогрессии на основании полученных морфологических данных (количество опухолевых очагов, их диаметр, наличие сопутствующей карциномы in situ) и удаление видимых новообразований.
После выполнения трансуретральной резекции мочевого пузыря (ТУР МП) всем больным проводится однократная ранняя (в течение 6 ч) инстилляция химиопрепарата (химиопрепарат — по выбору врача) в мочевой пузырь, так как было доказано, что при этом уменьшается частота рецидивов. Основная цель внутрипузырной лекарственной терапии опухолей МП состоит в максимальном воздействии лекарственного препарата на остатки опухоли (раковые клетки).
Дальнейшее лечение после ТУР МП и однократной инстилляции химиопрепарата зависит от результатов гистологического исследования и группы риска, к которой относится пациент. Внутрипузырная пострезекционная лекарственная химио- или иммунотерапия является вторым после ТУР методом лечения мышечно-неинвазивного РМП.
Внутрипузырную лекарственную терапию подразделяют на профилактическую, проводимую для предотвращения возникновения рецидивов после удаления всех видимых опухолей МП, и лечебную, проводимую с целью эрадикации остаточных, частично резецированных и неудалимых опухолей
Лечение после ТУР МП и ранней однократной инстилляции химиопрепарата:
- В группе низкого риска: дальнейшее лечение может не проводиться, поскольку вероятность рецидива и прогрессии незначительна.
- В группе высокого риска: адъювантная внутрипузырная иммунотерапия вакциной БЦЖ (в полной дозе) с поддерживающей терапией в течение 1-3 лет. При высочайшем риске прогрессии опухоли или неэффективности БЦЖ-терапии показана цистэктомия.
- В группе промежуточного риска: адъювантная внутрипузырная химиотерапия (препарат выбирается врачом) продолжительностью не более 1 года или адъювантная внутрипузырная иммунотерапия вакциной БЦЖ (в полной дозе) с поддерживающей терапией 1 год.
По виду используемого агента внутрипузырную терапию делят на химиотерапию (ХТ) и иммунотерапию (ИТ), которые отличаются по механизму действия используемых препаратов, показаниям, продолжительности лечения и эффективности. 35 различных лекарственных веществ, включая цитостатики, иммуномодуляторы и витамины, были использованы с адъювантной целью при Та, Т1 стадии РМП, и лишь некоторые из них оказались эффективными.
По рекомендуемым для внутрипузырной терапии химиотерапевтическим агентам включая митомицин C, доксорубицин, эпирубицин, гемцитабин, вальрубицин, пирарубицин и тиотепа в настоящее время нет консенсуса относительно того, какой препарат способствует лучшим онкологическим результатам.
Оптимальные виды лечения мышечно-неинвазивного рака мочевого пузыря:
- Радикальная трансуретральная резекция;
- Внутрипузырная пострезекционная лекарственная терапия.
Лечение мышечно-инвазивного рака мочевого пузыря
Мышечно-инвазивный РМП — потенциально смертельное заболевание, так как без лечения больные погибают в течение 24 месяцев. Основным единственно радикальным методом лечения мышечно-инвазивного РМП (Т2–Т4а, N0, М0) является радикальная цистэктомия — удаление вместе с мочевым пузырем у мужчин предстательной железы с семенными пузырьками и покрывающей брюшиной, а у женщин — матки, придатков, фаллопиевых труб, уретры, передней стенки влагалища. Неотъемлемой частью цистэктомии является удаление лимфатических узлов.
Радикальная цистэктомия показана также при невозможности проведения органосохранного лечения мышечно-неинвазивного РМП, неблагоприятного прогноза и его рецидивов. Согласно рекомендациям NCCN от 2017 года и EAU от 2017 года, такой объем вмешательства при немышечно-инвазивном РМП показан лишь в следующих ситуациях: при отсутствии ответа на иммунотерапию вакциной БЦЖ после проведенной ТУР при рецидиве опухоли/ей (при цитологически подтвержденном диагнозе).
В настоящее время широко используются лапароскопические методики. Для сохранения сексуальной функции у мужчин выполняют нервосберегающую цистэктомию с сохранением сосудисто-нервных пучков.
Неотъемлемой частью радикальной цистэктомии является восстановление резервуарной функции мочевого пузыря. Существуют различные методики кишечной пластики мочевого пузыря, в настоящее время доведенные до совершенства.
Радикальная цистэктомия обеспечивает 5-летнюю выживаемость только у 50% больных. В связи с этим, начиная с 1980-х гг., для улучшения подобных неудовлетворительных результатов используют дооперационную химиотерапию. Применение неоадъювантной цисплатинсодержащей комбинированной ХТ способствует улучшению общей 5-летней выживаемости на 5–8 %
Цистэктомия спасения показана больным, у которых неэффективна консервативная терапия, при рецидивах после лечения с сохранением мочевого пузыря, при наличии непереходно-клеточных опухолей и только с паллиативной целью.
Выполнение только ТУР при мышечно-инвазивном РМП не относится к радикальному лечению.
Дистанционная лучевая терапия может служить альтернативным методом лечения для пациентов с противопоказаниями к выполнению радикальной операции.
Общие принципы лекарственного лечения распространенного рака мочевого пузыря
Лекарственное лечение распространенного рака является паллиативным и направлено на увеличение продолжительности жизни и улучшения ее качества. Выбор варианта лечения определяется состоянием пациента и выделительной функции почек.
Платиносодержащая комбинированная ХТ (MVAC, цисплатин + гемцитабин) является золотым стандартом и может увеличить продолжительности жизни больных до 14,8 и 13,8 мес. соответственно. Комбинация «цисплатин + гемцитабин» имеет более низкий профиль токсичности, что способствует более частому её применению. Высокодозный MVAC с использованием Г-КСФ обеспечивает большую плотность дозы, менее токсичен, чем стандартный MVAC,и обеспечивает большую частоту полных ответов и 2‑летнюю выживаемость.
Карбоплатин-содержащая ХТ не является равноэффективной комбинациям на основе цисплатина и не может рассматриваться в качестве стандарта , за очень редким исключением. Несколько исследований II фазы, посвящённых сравнению карбоплатина и цисплатина, указывают на более низкую эффективность режимов с карбоплатином. Более 50 % пациентов с уротелиальным раком не подлежат цисплатин-содержащей ХТ. Причинами отказа от использования цисплатина являются тяжелое общее состояние пациента, почечная недостаточность, потеря слуха и периферическая нейропатия >2 ст., СН III класса по NYHA. При противопоказаниях к введению цисплатина могут быть использованы комбинации на основе карбоплатина либо монотерапия гемцитабином или таксанами.
Новое направление в лечении распространенного рака мочевого пузыря сопряжено с прорывными технологиями в лекарственной терапии и связаны с внедрением в практику новой иммунотерапии, основанной на ингибировании контрольных точек PD1/ PD-L1
Атезолизумаб (Tecentriq), Авелумаб (Bavencio), Дурвалумаб (Imfinzi) — эти три препарата блокируют белок PD-L1, который находится на поверхности раковых и некоторых других клеток, взаимодействует с молекулой PD-1 на поверхности T-клеток, подавляет их активность и тем самым «усыпляет» противоопухолевый иммунитет.
Два препарата — Ниволумаб (Opdivo) и Пембролизумаб (Keytruda) — блокируют белок PD-1, который находится на поверхности T-клеток и взаимодействует с белком PD-L1.
Эффективность этих иммунопрепаратов при раке мочевого пузыря была убедительно доказана в ходе клинических исследований.
Американское Управление по контролю качества медикаментов и пищевых продуктов (FDA) одобрило атезолизумаб и пембролизумаб при местно-распространенных и метастатических злокачественных опухолях мочевого пузыря в ускоренном порядке в 2017 году по результатам двух исследований. В них частота общего ответа составила 23,5% для атезолизумаба и 28,6% для пембролизумаба. Продолжают изучаться новые препараты, а также их комбинации, что дает надежды в улучшении результатов лечения распространенных опухолей в будущем.
Прогноз. Профилактика
Позднее обращение за медицинской помощью больных с симптомами заболевания соответствует низким показателям выживаемости и большей вероятности рецидивирования.
Из-за риска рецидива и прогрессирования пациенты с опухолями мочевого пузыря стадии Та, Т1 и с карцинома in situ должны проходить регулярное обследование согласно протоколу. Всем пациентам с опухолями стадии Та, Т1 и с карцинома in situ следует обязательно провести первую цистоскопию 3 мес. спустя после ТУР. Регулярные (ежегодные) визуализации верхних мочевыводящих путей (КТ-внутривенная урография или внутривенная урография)
рекомендуются в случае опухолей высокого риска. Необходимо:
- отказаться от активного и пассивного курения;
- соблюдать водно-питьевой режим;
- устранить профессиональные вредности, контакт с химикатами. Рабочие должны быть проинформированы о возможном канцерогенном эффекте различных веществ, длительности воздействия и латентном периоде развития РМП;
- своевременное лечение воспалительных заболеваний мочевого пузыря.
